依據歐盟施行的個人資料保護法,我們致力於保護您的個人資料並提供您對個人資料的掌握。
按一下「全部接受」,代表您允許我們置放 Cookie 來提升您在本網站上的使用體驗、協助我們分析網站效能和使用狀況,以及讓我們投放相關聯的行銷內容。您可以在下方管理 Cookie 設定。 按一下「確認」即代表您同意採用目前的設定。








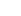

外泌體近年來在醫美與再生醫療領域備受關注,不少品牌與診所都開始導入含有外泌體成分的產品。不過,外泌體真正的品質與效果,並不是只靠成分標示說了算,而是取決於背後的製程技術。
我們會用簡單明瞭的方式,帶你一步步掌握外泌體製程從製造到出貨的關鍵技術,並說明每一個步驟的功能與意義。即使你不是技術背景,也能輕鬆看懂這些流程對產品品質有多關鍵。
外泌體製程,簡單來說就是將細胞培養、收集外泌體、進行純化與封裝的一整套流程。雖然每個步驟看似獨立,但其實彼此環環相扣,任何一段出問題,都可能影響最終產品的品質與穩定性。
整體來說,外泌體製程可分為四大階段:
透過這 4 個關鍵技術,你不僅能提升外泌體產品的品質與一致性,也能在法規合規、市場競爭與國際合作上搶得先機。
外泌體是細胞分泌的微小囊泡,因此,細胞本身的狀態,就直接決定了外泌體的品質與活性。如果細胞健康、代謝良好,所釋放的外泌體會更具功能性;反之,老化或壓力大的細胞可能產出品質參差不齊的外泌體。
尤其在商業應用中,一致性是關鍵。只有穩定地擴增細胞、維持相同培養條件,才能確保每一批產品都符合規格,降低品質波動與後續風險。
在外泌體製程中,細胞擴增通常會使用以下兩種方式:
此外,搭配自動換液系統、氣體監控設備,可進一步提升操作效率與細胞存活率,並降低污染風險。這些設備都可以納入後續的 AIoT 製程監控,實現標準化與可追蹤的操作。
雖然實際產量會因細胞類型與條件而異,但根據模擬數據,一般可做以下估算:
| 培養方式 | 每批預估產量(3000E/瓶) | 建議應用場景 |
|---|---|---|
| 傳統2D培養 | 約 1000 瓶/批 | 實驗、研發階段 |
| 高效擴增配置 | 約 8,000-20,000 瓶/月 | 商業化量產 |
透過最佳化的細胞培養設計,不僅能提高外泌體產出效率,也能減少資源浪費,提升整體製程效益。
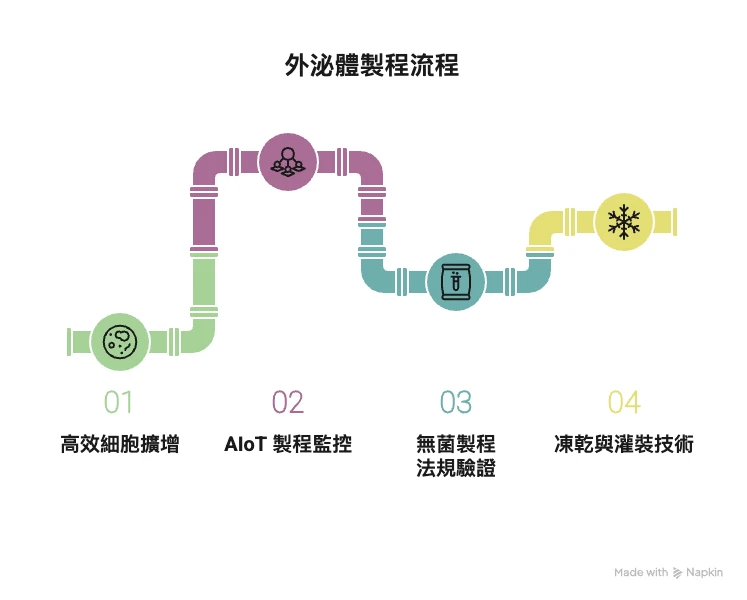
AIoT 是「人工智慧(AI)」結合「物聯網(IoT)」的製程管理技術,在外泌體製造中,它的角色就像一位不會休息的專業監工。
傳統的細胞製程仰賴人工觀察與手動操作,容易因為人為疏忽或環境變數導致失誤。而導入 AIoT 系統後,可以即時掌握每一個關鍵數據,如溫度、pH、氣體濃度與壓力變化,並即時發出預警、調整條件,大幅提升整體製程的穩定性與安全性。
AIoT 系統可橫跨整條製程線,涵蓋:
此外,這些資料都會自動上傳並儲存於中央資料庫,方便日後查帳、品質審核或法規驗證時使用。
導入 AIoT 製程對外泌體產品開發與工廠管理者而言,有三大明顯優勢:
在國際法規日趨嚴格、客戶要求透明度提高的趨勢下,AIoT 製程已不再是加分項,而是未來外泌體製造的必要標配。
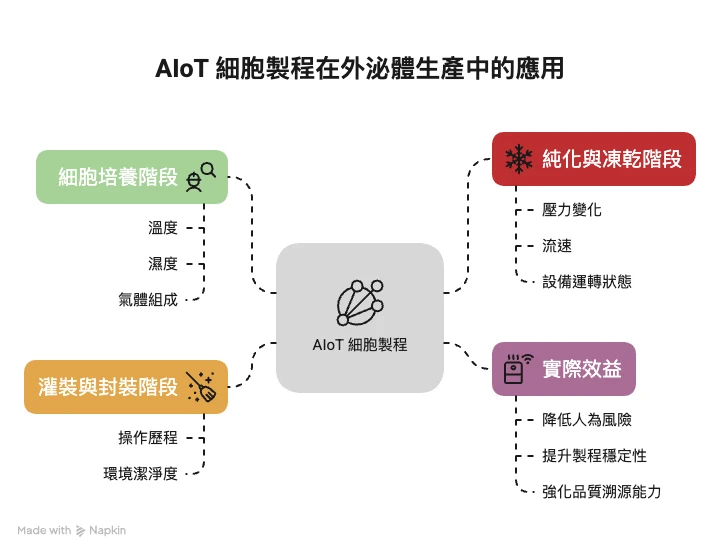
PIC/S GMP 是由國際藥政單位協力制定的藥品製造規範,目的在於確保產品在「品質、安全、無菌」等方面達到一致性。
在過去只適用於藥品製造,但如今,細胞治療與外泌體等再生醫療產品也越來越常被納入 GMP 規範中管理。
若你希望外泌體產品能夠進入國際市場、用於臨床研究,甚至是作為高階保養品原料,符合 GMP 的製程與環境就是基本門檻,沒有符合將無法商品化,也無法通過查廠。
在外泌體製程中,下列幾個階段為污染高風險區:
可以使用以下方式:
2023 年起,PIC/S GMP 已全面修訂,要求更嚴謹的污染控制策略(Contamination Control Strategy, CCS)。幾項與外泌體製程最密切的重點包含:
也就是說,即使你操作上沒問題,也必須「有紀錄可查、符合查廠要求」,才能符合 PIC/S GMP 的規範。
外泌體是極其敏感的生物顆粒,在常溫或冷藏條件下很容易失去活性。因此,將外泌體進行凍晶乾燥(Lyophilization)是目前最主流的保存方式。
透過凍乾,外泌體可轉換為粉末狀,不僅便於保存與運輸,還能提升穩定性與使用靈活性(例如溶解進精華液或注射劑中)。
如果不經凍乾處理,產品的儲存條件就會受限、保存期限縮短,甚至在運送過程中可能因溫度變化導致變性。
凍乾設備本身不具備無菌操作功能,因此,若要避免污染,必須在「無菌隔離環境」下進行凍乾與灌裝操作。常見的做法包括:
這樣的配置,不但能確保凍乾過程的無菌性,也符合國際藥品製程中的 aseptic filling 標準。
根據 2023 年起更新的 PIC/S GMP 規範,凍乾製程被納入污染控制策略(CCS)的重點關卡。以下幾點為凍乾作業必須注意的合規要求:
對外泌體工廠而言,凍乾製程不再只是技術選項,而是合規與出口的必要條件。
這一段讓讀者理解:凍乾不只是為了保存,更是合規的一部分。它與前面的「GMP 製程」緊密相連,並為後續的產品使用與物流鋪路。
打造一款真正高品質的外泌體產品,絕不是只靠原料來源,更重要的是整套製程流程是否到位、穩定、合規。
從高效細胞擴增打下生產基礎,到導入 AIoT 製程監控提升穩定性,再結合符合 PIC/S GMP 的無菌作業,最後通過 凍乾技術確保保存與運輸安全,這四大核心製程就像是外泌體產品的四根支柱,缺一不可。
無論你是準備規劃工廠、委託代工,或評估產品品質,了解這些製程技術都能幫助你做出更明智的選擇,也讓你的產品在市場上更具說服力與信賴感。
了解了外泌體抗衰老全攻略,你可能會問:「那有沒有值得信賴的外泌體產品來源?」
答案是,有的。從源頭把關,是確保療程效果和安全性的關鍵。
我們提供從零開始的完整規劃,包括:
讓你快速建立合規、安全、可量產的製造流程。
我們的 YJ-Isolator 專為細胞與外泌體製備設計,整合:
並可依照你的製程需求客製調整,是理想的GMP-ready 解決方案。
讓你專注開發產品,我們幫你穩定供應關鍵原料與技術。
Manufacturing Therapeutic Exosomes: from Bench to Industry — 探討外泌體製程完整流程與 GMP 挑戰。
Review on Strategies and Technologies for Exosome… — 概述外泌體分離技術與大規模 GMP 製程。
Freeze‑Dried Extracellular Vesicles From Adipose‑Derived… — 凍乾外泌體技術與保護劑應用研究
Guidance on the clinical application of extracellular vesicles — 強調臨床級外泌體無菌製程與污染控管
Exosomes Produced in Bioreactors — 生物反應器提升外泌體量產實例。
依據歐盟施行的個人資料保護法,我們致力於保護您的個人資料並提供您對個人資料的掌握。
按一下「全部接受」,代表您允許我們置放 Cookie 來提升您在本網站上的使用體驗、協助我們分析網站效能和使用狀況,以及讓我們投放相關聯的行銷內容。您可以在下方管理 Cookie 設定。 按一下「確認」即代表您同意採用目前的設定。
隱私權偏好設定中心
依據歐盟施行的個人資料保護法,我們致力於保護您的個人資料並提供您對個人資料的掌握。
按一下「全部接受」,代表您允許我們置放 Cookie 來提升您在本網站上的使用體驗、協助我們分析網站效能和使用狀況,以及讓我們投放相關聯的行銷內容。您可以在下方管理 Cookie 設定。 按一下「確認」即代表您同意採用目前的設定。
管理同意設定
必要的Cookie
網站運行離不開這些 Cookie 且您不能在系統中將其關閉。通常僅根據您所做出的操作(即服務請求)來設置這些 Cookie,如設置隱私偏好、登錄或填充表格。您可以將您的瀏覽器設置為阻止或向您提示這些 Cookie,但可能會導致某些網站功能無法工作。